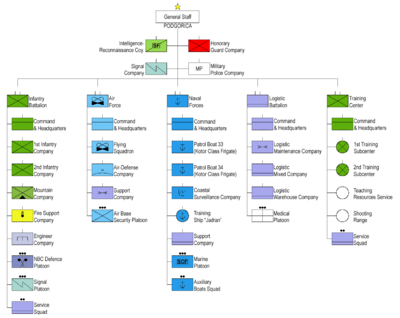
لینکونه، لینکونه، لینکونه؟
د الکترو کیمیا سره مخامخ شوې برخه 5
د تیرو غونډو په جریان کې، موږ د ګالوانیک حجرو ډیری مثالونه لیدلي - هغه چې یوازې تاریخي اهمیت لري او نور یې نن ورځ کارول کیږي. د حجرو نړۍ خورا بډایه ده، نو دا د دې وخت دی چې سیسټمونه د هغو څخه توپیر معرفي کړي چې تر اوسه ښودل شوي.
غیر فلزات هم نیمه حجرې کیدی شي
لومړی، یوه تجربه چې د مصرف شوي Leclanchet عناصرو څخه دوه ګرافیت الیکټروډونو ته اړتیا لري، زنک برومایډ ZnBr2، د بریښنا رسولو (لکه د 4,5V بیټرۍ) او یو لازمي ولتاژ میټر. د کور په لابراتوار کې، البته، موږ به وړاندیز شوي زنک مالګه ونه موندلو، مګر زموږ په قضیه کې به دا په بریالیتوب سره د پوټاشیم برومایډ KBr او زنک سلفیټ (VI) ZnSO سره ځای په ځای شي.4. موږ یو سیټ راټولوو چې د دوه ګرافیټ لرګیو څخه جوړ دی، دا بورډ ته وتړئ ترڅو الیکټروډونه په جزوي ډول په شیشې کې ډوب شي.
موږ د تارونو ټوټې په الیکټروډونو سره نښلوو، په غوره توګه د سولډرینګ اوسپنې سره (له همدې امله، کله چې دوی د زړو بیټرۍ څخه لیرې کړئ، د ګرافیت په راډونو کې د پیتل "کیپس" پریږدئ). موږ به د 50-100 سانتي مترو په ظرفیت سره د بیکر سره د ابعادو سره د کارت بورډ له یوې ټوټې څخه ډایفرام هم جوړ کړو.3 (د کارت بورډ سربیره د پن سره سوری کیدی شي).
اوس موږ د ذکر شوي مالګې یوه برخه په اوبو کې منحل کوو، او بیا ګیلاس د چمتو شوي محلول سره ډک کړئ (متمرکز 5-10٪). ریک د الیکټروډونو سره د برتن په څنډه کې ځای په ځای کړئ ، او د تارونو پایونه د فلیټ بیټرۍ د پیتل تختو سره وصل کړئ (په اوس وخت کې قطبي اهمیت نلري) او جوړ شوی سیسټم وګورئ.
نږدې سمدلاسه، د سپینو زرو سپین رنګه پرت د بیټرۍ منفي ټرمینل سره وصل شوي الکترود باندې زیرمه کیږي. د فلزي زنک څخه جوړ شوی. د محلول یو ژیړ نسواري رنګ د دوهم الکترود سره نږدې د بیټرۍ مثبت قطب سره وصل لیدل کیږي. وړیا برومین د ګرافیت راډ ته نږدې رنګ شوی. د 5 دقیقو وروسته، تارونه د بیټرۍ ترمینلونو څخه جلا کړئ. د ولټمیټر په کارولو سره، ولتاژ اندازه کړئ (د میټر "منفی" د فلزي پرت پوښل شوي الیکټروډ سره وصل دی).
پرته له دې چې هغه پروسو ته لاړ شي چې د الکترولوز په جریان کې پیښیږي (موږ به یې په لاندې غونډو کې په یوه کې بحث وکړو)، موږ کولی شو دې پایلې ته ورسوو چې رامینځته شوی حجره دوه الکترودونه لري: زنک (د فلزي زنک د Zn په محلول کې په ګرافیټ کې زیرمه شوي.2+) او برومین (د برومین او برومایډ د وړیا ایونونو محلول Br?). کاربن یوازې د بریښنا کنډکټر دی (په عمل کې، غیر عکس العمل مادې په ځینو شرایطو کې، لکه ګرافائٹ، پلاټینیم، ډیری وختونه د الکترود موادو په توګه کارول کیږي).
راځئ چې اوسنی ریسیور له الکتروډونو سره وصل کړو؟ د 1,5 V عملیاتي ولتاژ سره د رڼا بلب (په دې حالت کې، د اړیکو قطبیت هم مهم نه دی). لکه څنګه چې انرژي له سیسټم څخه ایستل کیږي، موږ په یوه الکترود کې د فلزي زیرمو تدریجي ورکیدل او په بل اړخ کې ژیړ رنګ ګورو. مخکې خوشې شوي مادې عکس العمل ښیې ، خپل اصلي حالت بیرته راګرځوي. غبرګون د نښلونکي تار له لارې د الکترونونو لیږد سره غیر مستقیم دی. دا د galvanic حجرو جوهر دی.
زموږ په سیسټم کې کوم عکس العملونه پیښ شوي؟ د زنک الکترود لپاره، موږ یقینا کولی شو د پروسې مساوات ورکړو:
(-)Zn0 ؟ زنک2+ +2e-
په دوهم الکترود کې، وړیا برومین د برومین اینونونو ته راټیټیږي:
(+) نه.2 +2e- ، 2 پی سیز-
په دې توګه، د حجرو سکیم په لاندې ډول دی (موږ د پوټاشیم او سلفیټ (VI) آیونونو څخه ډډه کوو، کوم چې په عکس العمل کې برخه نه اخلي):
(-)С، Zn | ZnBr2aq؟ ZnBr2aq | С(+)
موږ اړتیا نلرو چې په حجره کې اپرچر وکاروو. په هرصورت، د دې کارول به د برومین مخه ونیسي چې د زنک لیپت الیکټروډ ته نږدې مهاجرت وکړي او په مستقیم ډول د حجرو ترمنځ غبرګون وکړي.
غیر فلزات د فلزي عناصرو په څیر نیمه حجرې جوړوي. دا یوازې اړین دی چې په مناسب حل کې ډوب شوي کنډکټر وکاروئ ، کوم چې د بریښنایی لیږد کې برخه اخلي. د هالوجن لپاره، معیاري پوټینشنونه په لاندې ډول دي (د الکترود غبرګون د برومین لپاره ورته ورته دی):
| نیمه حجره | F2/F? | Cl2/ کل? | Br2/ بر? | I2/I? |
| E0 [وی] | + 2,87 | + 1,36 | + 1,07 | + 0,54 |
د فلورین په حالت کې، احتمالي ارزښت (د ټولو نیمه حجرو څخه لوړ ټاکل شوی) حساب شوی، نه اندازه شوی. دلیل، لکه څنګه چې د الکالي او الکلین ځمکې فلزاتو په قضیه کې، د اوبو سره د فعال عنصر غبرګون دی.
redox حجره
د بلې تجربې لپاره، موږ به لاندې حلونه چمتو کړو: اوسپنه (III) کلورایډ، FeCl3 د 5٪ غلظت سره ، د پوټاشیم آیوډیډ KI د 10٪ غلظت سره او د اوبو نشایسته تعلیق. په یو ټیسټ ټیوب کې یو څو سانتي متره مخلوط کړئ3 د مالګې حلونه، او یو څه وروسته د نشایسته تعلیق یو څو څاڅکي اضافه کړئ. د منځپانګې تور نیلي رنګ د وړیا آیوډین شتون په ګوته کوي. عکس العمل د مساوات لخوا لیکل شوی:
2 فیس3+ + 2i- ؟ 2Fe2+ + زه2
د اوسپنې (III) کیشنونه آیوډیډ ایونونه آزاد عنصر ته اکساید کوي، اوسپنه (II) آیونونو ته کموي.
د نشایسته شاخص رنګ کې بدلون د آیوډین ذراتو شتون تایید کړ، مګر ایا په ریښتیا Fe cations جوړ شوي؟2+؟ راځئ چې دا فرضیه ازموینه وکړو. د اوسپنې (II) کیشنونو د کشف لپاره یوه ځانګړتیا ازموینه د پوتاشیم هیکساسیانوفریټ (III) K سره عکس العمل دی.3[Fe(CN)6]، معمولا د پوتاشیم فیریکیانایډ په نوم پیژندل کیږي. مرکب سور کرسټالونه جوړوي، د ورته نوم د پوتاشیم فیروکینایډ په مقابل کې (پوتاشیم (II) hexacyanoferrate K.4[Fe(CN)6]) د زرد کرسټال سره ? راځئ چې دا دوه اړیکې ګډوډ نکړو. موږ پخوانۍ تجربه تکراروو، مګر د نشایسته تعلیق پر ځای، موږ د پوټاشیم فیریکانایډ د 1٪ محلول یو څو څاڅکي اضافه کوو. یوځل بیا، د عکس العمل رګ مینځپانګه د ټرنبل نیلي په نوم د پیچلي ترکیب له امله تیاره نیلي بدلیږي:
3 فیس2+ + 2 [Fe (CN)6]3- ؟ Fe3[Fe(CN)6]2
زه وړاندیز کوم چې کافران د فیرس او فیریک اوسپنې مالګې سره ازموینه ترسره کړي. موږ یوازې په لومړي حالت کې نیلي رنګ ترلاسه کوو.
اوس، په دوه کوچنیو بیکرونو کې چې د 50-100 ملی لیتر ظرفیت سره، د اوسپنې (III) کلورایډ او پوتاشیم آیوډیډ ډیری محلولونه واچوئ.3. په هر یو برتن کې، د ګرافیت الیکټروډ د تار سره وصل کړئ (په مناسب سټینډ کې کیښودل شو ترڅو شیشې ته ونه لویږي). همدارنګه، د پوټاشیم آیوډیډ محلول سره یو برتن ته لږ نشایسته تعلیق اضافه کړئ. د حجرې د جوړولو لپاره، تاسو به د الکترولوټیک کیلي ته هم اړتیا ولرئ (د تیرو غونډو څخه یوه جوړه شوې؟ د KNO په متمرکز محلول کې د بلټینګ کاغذ یوه پټه کافي ده.3). د الیکټروډونو څخه د لیډونو پایونه د ولټاژ اندازه کولو لپاره نصب شوي یونیورسل میټر ترمینل سره وصل دي.
موږ پخپله د ولټمیټر ارتباط قطبیت د آیوډین انونونو سره د اوسپنې (III) کیشنونو عکس العمل لپاره د معادلې تحلیل پراساس ټاکو ، موږ یادونه کوو چې کوم ایونونه دوی ورکوي او کوم الیکټرون ترلاسه کوي. د میټر لوستل د ګالوانیک حجرو عملیات تاییدوي. بیا موږ وسیله اوسني اندازه کولو ته واړوو. دا کوچنی دی (د څو لسګونو mA ترتیب) ، نو موږ اړتیا نلرو کوم اضافي ریسیور وکاروو (د مثال په توګه ، د څراغ بلب) ترڅو وسیله له زیان څخه خوندي شي. د پوټاشیم آیوډیډ محلول سره په بیکر کې ډوب شوي الکترود شاوخوا د تیاره نیلي رنګ رامینځته کول په سیسټم کې د عکس العمل کورس ته ګواهي ورکوي. کله چې موږ د اوسپنې (III) مالګې شیکر ته لږ پوټاشیم فیریکیانایډ محلول اضافه کړو؟ هم په کې. راځئ چې په شیشې کې د پروسو معادلې ولیکئ:
(-)2I- ? 2 +2e-
(+)2Fe3+ +2e- ؟ 2Fe2+
او د حجرو ډیاګرام:
(-) سره | CIaq || FeCl3aq | سي (+)
ورته عکس العملونه په حجره کې پیښیږي لکه څنګه چې په ټیسټ ټیوب کې د فرعي سټیټونو مخلوط کولو وروسته (دا د اړخونو لخوا د انوډیک او کیتوډیک پروسې اضافه کولو لپاره کافي دي) ، او د بدلونونو ځایي جلا کول دا امکان ورکوي چې د لیږد شوي بریښنایی انرژي کارول شي. د حجرې د نیمو برخو ترمنځ.
هغه حجره چې موږ یې جوړوو د ریډکس سیل په نوم یادیږي. نوم عام دی مګر ګمراه کونکی. په هرصورت، موږ پوهیږو چې د اکسیډریشن او کمولو پروسې په هر لینک کې واقع کیږي. د ریډکس عکس العمل سمت څنګه وټاکئ (دواړه په حجره او ټیسټ ټیوب کې ترسره کیږي)؟ طریقه ساده ده:
1. په فزیکي او کیمیاوي جدولونو کې، آیا موږ د اړونده نیمه حجرو معیاري پوټینشنونه پیدا کوو؟ د Fe سیسټم لپاره3+/ ایمان2+ دا +0,77 V دی؛ زما لپاره2/I?: +0,54V
2. یو سیسټم چې لوړ ظرفیت لري په عکس العمل کې د اکسیډیز کولو اجنټ (د حجرې کیتوډ) او نیم حجره د ټیټ ظرفیت سره؟ د حجرې anode، یعنی د کمولو اجنټ.
3. په هرصورت، دا باید په یاد ولرئ چې د سیسټمونو لپاره چې د معیاري پوټینشنونو په ارزښتونو کې لږ توپیر لري، په ځینو مواردو کې، رولونه بدلیدلی شي (حقیقي پوټینشنونه، د نورو شیانو په منځ کې، د ریجنټونو په غلظت پورې اړه لري).
د تیلو حجره
موږ به د لومړۍ تجربې څخه سیسټم راټول کړو، یوازې د پوټاشیم برومایډ او زنک سلفیټ (VI) محلول د سلفوریک اسید (VI) 10٪ محلول سره ځای په ځای کړو.2SO4. د 1-2 دقیقو الیکټرولیسز وروسته (په الیکټروډونو کې د ګاز خوشې کیدو سره پیښیږي) ، د بریښنا سرچینه بنده کړئ او په احتیاط سره ، ترڅو د ګرافیت له سطحې څخه د ګاز بلبلونه لرې نه کړئ ، ولټاژ د ولټ میټر سره اندازه کړئ. لینک جوړ شو! د اوسني اندازه کولو حالت ته د وسیلې بدلولو وروسته ، یو څوک کولی شي د عکس العمل په جریان کې د ګرافیت الیکټروډونو په سطح کې د ګاز بلبلونو ورکیدل مشاهده کړي. پرته له دې چې د پروسې توضیحاتو ته لاړ شو چې په الکتروډونو کې د وړیا اکسیجن او هایدروجن د راټولولو لامل شو، په حجره کې عکس العملونه په لاندې ډول دي:
(-) 2H2؟ 4 ساعته+ +4e-
(+) د2 + 4 کورونه+ +4e- ؟ 2ه2O
په مجموع کې، د عناصرو څخه د اوبو د ترکیب غبرګون واقع کیږي.

جوړ شوی سیسټم د تیلو سیل ماډل دی. د تیلو او اکسیډیزر تر مینځ د عکس العمل انرژي مستقیم تبادله بریښنا ته د اقتصاد له نظره خورا ګټوره ده؟ هیڅ اړتیا نشته چې د احتراق تودوخه په بخار انرژي بدله کړي، کوم چې یوازې توربینونه چلوي. د حیرانتیا خبره نده، دا ډول سیسټمونه د انرژۍ ستونزې حل کولو لپاره ډیزاین شوي (او ضایع پاکې اوبه دي). په هرصورت، د ودانیزو توکو بیه او د هایدروجن تولید ته اړتیا یو لوی خنډ دی.
که څه هم د تیلو حجرې په خورا ټیکنالوژیکي پرمختللو برخو کې د بریښنا تولید لپاره کارول شوي ، لکه د فضا الوتنه (په ځینو صنعتونو کې لګښتونه ثانوي رول لوبوي) ، د دوی تاریخ خورا اوږد دی. د هایدروجن-اکسیجن حجرې لومړی کاري پروټوټایپ په 1839 کې د برتانوي اختراع کونکي ویلیم رابرټ گرو لخوا جوړ شو.
مقاله د لینکونو ډیری ډولونه وړاندې کوي، د هغو څخه توپیر لري چې په تیرو غونډو کې بحث شوي. د نورو قسطونو په څیر؟ یوازې د دې سیسټمونو ستونزې، چې نه یوازې د انرژي سرچینې په توګه مهم دي، په ګوته شوي. په هرصورت، د مناسب متن اندازه ساتلو اړتیا دا ناممکن کوي چې د لینکونو پورې اړوند ډیری په زړه پورې موضوعاتو بحث وکړي (زه لیوالتیا لوستونکي هڅوم چې پخپله د معلوماتو لټون وکړي). د دورې په راتلونکې برخه کې، موږ به د نیم حجرو امکاناتو جدول تحلیل کړو. د زړه پورې تجربو وړاندیزونه به هم وي.
بریښنایی غوښتنلیک
redox حجره
هر الیکټرو کیمیکل حجره د اکسیډریشن څخه تیریږي (په انود کې) او کمښت (په کیتوډ کې). په هرصورت، په کیمیاوي جرګون کې، ریډکس حجرې د یو ځانګړي ډول سیسټم په توګه راجع کیږي.
د تجربې لپاره، د پوتاشیم آیوډیډ KI او اوسپنې (III) کلورایډ FeCl حل ته اړتیا ده.3 او د نشایسته (د کچالو اوړو) د اوبو تعلیق. تاسو به د پوټاشیم نایټریټ (V) KNO متمرکز محلول سره ډک شوي الیکټرولیک کیلي ته هم اړتیا ولرئ3. که موږ کیلي نه لرو، دا کافي ده چې څو ځله د نسج کاغذ یوه پټه یا د پنبې تار د پوټاشیم نایټریټ په محلول کې لمده کړئ.
موږ به د ګرافیټ راډونه د کارول شوي لیکلانچ حجرو څخه د الکترودونو په توګه وکاروو (عکس 1). د الیکټروډ پایونه د تار سره لنډ کړئ او د KI محلولونو (د نشایسته سلیري اضافه کولو سره) او FeCl سره یې په بیکرونو کې ډوب کړئ.3. برسېره پردې، موږ په شیشې کې حلونه د الکترولوټیک کیلي یا د هغې یو بدیل سره یوځای کوو (عکس 2). د یو څه وخت وروسته، ارغواني لیکې د پوټاشیم آیوډیډ محلول (عکس 3) سره په شیشې کې څرګندیدل پیل کوي ، په تدریجي ډول رګ په تیاره رنګ کې رنګ کوي (عکس 4 او 5). دا د نشایسته مالیکولونو سره د وړیا آیوډین مالیکولونو ترکیب یو ځانګړتیا محصول دی. آیوډین د حجرې په انود کې د آیوډیډ انونونو د اکسیډریشن په پایله کې رامینځته شوی:
(-) anode: 2I- ? 2 +2e-
په دوهم الکترود (کیتوډ) کې، د اوسپنې (III) ایون کم شوي:
(+) کټوډا: 2Fe3+ +2e- ؟ 2Fe2+
په تجربه کې رامینځته شوی ریډکس سیل لاندې سکیم لري:
(-)ج | CIaq || FeCl3aq | سي (+)
چیرته چې د کاربن سمبول C د ګرافیت الکترود او || ؟ الکترولیټیک کیلي. په سیسټم کې ټولیز عکس العمل د انون I اکسیډیشن دی- د Fe cations لخوا3+:
2 فیس3+ + 2i- ؟ 2Fe2+ + زه2
redox حجره
د غلظت حجره
د دویمې تجربې لپاره تاسو اړتیا لرئ: د مسو سلفیټ (II) CuSO محلول4د مسو الیکټروډونه، د پوټاشیم نایټریټ (V) KNO متمرکز محلول څخه ډک شوي الکترولیټیک کیلي3 او یونیورسل کاونټر. یو له بیکرونو څخه د CuSO محلول سره ډک کړئ.4او بل د 1:100 د ورته کمولو سره (د مثال په توګه، 0,5 سانتي متره3 د لومړي شیش څخه اخیستل شوي محلول، د 50 سانتي مترو په حجم کې اوبه اضافه کړئ3) (عکس 6). وروسته له دې چې د مسو تارونه په شیشونو کې ډوب کړئ او د الیکټرولیټیک کیلي سره سرکیټ بند کړئ، د حجرې د الکترودونو ترمنځ ولتاژ اندازه کړئ. دا کوچنی دی؟ شاوخوا یو درجن یا څو لسګونه ملی وولټ (عکس 7).
د مسو د تحلیل او ورښت غبرګونونه په الکترودونو کې واقع کیږي:
(-) anode: Cu0 ؟ سره2+ +2e- (لږ متمرکز حل)
(+) Cathode: Cu2+ +2e- ؟ سره0 (ډیر متمرکز حل)
د دواړو الکترود پروسو د معادلو له اضافه کولو وروسته، دا معلومه شوه چې هیڅ کیمیاوي تعامل په مجموع کې نه واقع کیږي! د حجرې چلولو ځواک یوازې د سیسټم هیله ده چې په دواړو شیشونو کې غلظت مساوي کړي.